[Прелесть химии] Зачем учить физхимию?
![[Прелесть химии] Зачем учить физхимию?](/content/images/size/w2000/2020/11/Chemistry2.jpg)
Все статьи из цикла "В чем прелесть предмета"
Другие статьи из цикла "В чем прелесть химии":
Строительные блоки материи
Неорганическая химия
Органическая химия
Полимеры
Синтез жизни
Чистый воздух
Химия и медицина: химическое оружие, аспирин и плесень
Так сложилось, что уже со школьной скамьи химия, физика и биология существуют раздельно в сознании у многих людей. На самом же деле, биология очень тесно связана с химией, а та, в свою очередь, тесно связана с физикой. И химия, и физика, и биология – естественные науки, которые существуют для того, чтобы объяснять явления окружающего нас мира. Вовсе неудивительно, что они неделимы.
Цикл наших статей называется “В чем прелесть химии”, но сегодня речь зайдет о великом и могучем разделе химии, который тесно переплетается с другой наукой – физикой.
Физическая химия – очень массивный раздел, предсказывающий поведение атомов, молекул, химических процессов и систем с помощью законов физики. Физическая химия слишком необъятна, чтобы рассмотреть ее полностью в рамках одной публикации, поэтому выделим три основные ее части: квантовую химию, химическую термодинамику и динамику химических систем. В этой статье мы посмотрим на каждый раздел поближе, изучим его базовые принципы и историю, а также посмотрим, что из себя он представляет сейчас.
Важно заметить, что квантовая химия – это применение квантовой механики к химическим системам, а химическая термодинамика – условное название термодинамики в химии. Поэтому, когда речь будет заходить о квантовой химии и химической термодинамике, мы скорее будем говорить о квантовой механике и термодинамике в целом.
Термодинамика
Почему одни реакции случаются, а другие – нет? А почему некоторые реагенты надо нагреть, чтобы реакция начала протекать? А почему существуют реакции, которые наоборот протекают быстрее при более низких температурах? Ответы на эти и многие другие вопросы дает химическая термодинамика.
Химическая термодинамика – наука, в центре которой стоит трансформация энергии в окружающем нас мире. Ученые издавна имели под рукой объекты изучения и методы анализа термодинамики, поэтому этот раздел увидел свет одним из первых.
У химической термодинамики, как и у любого раздела естественных наук, есть свой свод базовых правил и законов. Первый закон термодинамики формулировался Германом Гессом, Юлиусом Робертом фон Майером, Рудольфом Клаузиусом, Уильямом Ренкином и другими знаменитыми учеными на протяжении полувека.
Первый закон термодинамики – это всем известный закон сохранения энергии. Он гласит, что энергия не берется из ниоткуда и не уходит в никуда.

Рассмотрим обычный воздушный шарик в качестве химической системы. Он герметичен, но при этом ничто не мешает нагреть или охладить этот шарик. Изменить энергию газа внутри шарика возможно двумя путями: нагреть или охладить его или же совершить механическую работу над этим шариком, например, сжав или растянув его. Таким образом, путем теплопередачи или совершения работы энергия газа внутри шарика может изменить свое значение, не появляясь и не пропадая бесследно. Отсюда следует формула первого закона термодинамики: \[ \Delta U = q - w \], где \( \Delta U \) – изменение внутренней энергии; \( q \) – теплота, переданная системе; \( w \) – работа, совершенная системой.
Чтобы обсудить второй закон термодинамики, нам необходимо ввести функцию, которую ученые прозвали энтропией.
Энтропия – это величина, описывающая хаос.
Да-да, именно хаос. Энтропия описывает естественное стремление материи к хаосу, проявляющееся во многих формах. Представим любимую вазу вашей мамы, мирно стоящую на столе. Эта ваза обладает рядом параметров: массой, высотой, толщиной, плотностью, прозрачностью стекла и многим другим. В этот список можно добавить еще один параметр – энтропия вазы. Вся система (ваза) обладает неким значением энтропии. Вдруг ваза неудачно приземляется на пол, и нет уже никакой вазы в привычном понимании, а вместо нее – россыпь осколков. Аккуратно собранные осколки будут весить так же, как и сама ваза, некогда стоявшая на столе. А что насчет энтропии? Если бы существовал способ измерить абсолютное значение энтропии, то энтропия системы этих осколков была бы равна величине, отличной от энтропии целой вазы. Что очень логично! Ведь энтропия – это мера беспорядка, а множество стеклянных осколков действительно будут более удачным описанием беспорядка, нежели целая ваза.

Вот так на простом примере с любимой вазой мамы раскрывается второй закон термодинамики. Его можно сформулировать по-разному и опираться на разные явления физического мира, но мы выразим его следующим образом: всякая система стремится к наибольшему беспорядку.
Теперь, разобрав первый и второй законы термодинамики, мы можем перейти к одной из важнейших задач химии – ответу на вопрос "а если мы смешаем два соединения, что-то случится?". Рассмотрим на примере.
Основными составляющими воздуха, которым мы дышим, являются азот и кислород, однако из кислорода и азота может образовываться сильнодействующий яд – бурый газ диоксида азота \( NO_2 \), в народе известный как "лисий хвост". Но воздух вовсе не бур и не ядовит, так как в обычных условиях эта реакция не протекает. \[ N_2 + 2O_2 \rightarrow 2NO_2 \]

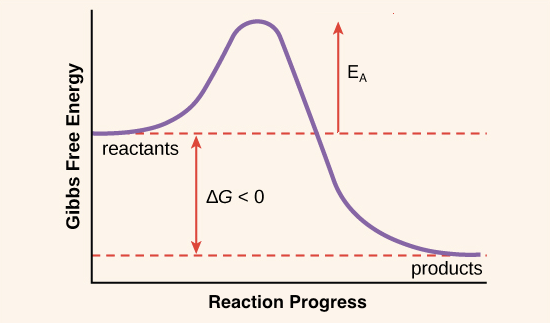
Как же с точки зрения химической термодинамики установить, будут ли реагировать два определенных вещества? Возможно, вы решите посмотреть на изменение энергии в ходе реакции и предпочтете ту реакцию, в которой система стремится к минимальной энергии. В конце концов, об энергии так часто говорится, особенно в рамках школьной программы, что вполне логично предположить, что она является главным мерилом всего. Однако, это не так! Химическая термодинамика утверждает, что спонтанны лишь те реакции, что не противоречат второму закону термодинамики.
Как это показать математически? Во-первых, нужно учесть изменение энтропии в ходе реакции \( \Delta S\). Во-вторых, важно помнить, что второй закон термодинамики описывает всю Вселенную, а не только одну систему (определенную реакцию), поэтому нужно еще учесть изменение энтропии окружающей среды. А энтропия окружающей среды изменяется за счет выделения или поглощения тепла в ходе реакции, изменение которого обозначается \( \Delta H\). В итоге, после нехитрых преобразований мы получаем энергию Гиббса \( \Delta G\) – метрику спонтанности реакций: \[ \Delta G = \Delta H - T \cdot \Delta S\]
Здесь мы ввели новую функцию под названием энтальпия. Энтальпия, \( H \) – это еще один термодинамический параметр, который является суммой внутренней энергии системы с произведением объема на давление: \[ H = U + P\cdot V ,\] где \( U \) – внутренняя энергия системы, \( P \) – давление, \( V \) – объем. Вообще, расчет абсолютного значения энтальпии по этой формуле – задание невыполнимое, так как оно включает в себя определение абсолютного значения внутренней энергии системы.
Однако не составит труда определить изменение энтальпии \( \Delta H \) в ходе реакции. \[ \Delta H = H_f - H_i = U_f + P_fV_f - U_i - P_iV_i\ = \Delta U + \Delta (PV) \]
А если мы посмотрим внимательнее на вторую часть уравнения, то мы можем увидеть, что \( \Delta (PV) = w \), где \( w \) – механическая работа. Таким образом, все выражение становится похожим на первый закон термодинамики, и тогда: \[ \Delta H = \Delta U + \Delta (PV) \ = q \]
Теперь мы с вами знаем, как определить значение изменения энтальпии – просто определить количество тепла, полученного системой в ходе реакции. С помощью изменения энтальпии можно посчитать и изменение энергии Гиббса. Если значение изменения энергии Гиббса некого процесса будет отрицательным, то реакция протекает при данной температуре. В случае положительного значения – реакция не происходит.
Вернемся к "лисьему хвосту". Почему азот и кислород все-таки не превращаются в ядовитый газ при обычных условиях? Изменение энтальпии в ходе реакции равно \( 33.2 кДж/моль\), изменение энтропии равно \( -249 Дж/моль \cdot К \). Таким образом, при температуре \( 298 К \) (\( 25 ^{\circ} C \)) изменение энергии Гиббса будет равно: \[ \Delta G = 33.2 кДж/моль - (298 К)\cdot(-249 Дж/моль \cdot К) = 51.3 кДж/моль \]
Величина положительная, из чего следует, что реакция не протекает при комнатной температуре. Вот так, очень просто химическая термодинамика может предсказать, будет ли протекать та или иная реакция!
Кванты
“Я думаю, что смело могу утверждать: квантовую механику не понимает никто”
– Ричард Фейнман
В начале прошлого века величайшие умы человечества столкнулись с проблемой – задачей об абсолютно черном теле. Давайте представим, что у нас существует некое тело, и, нагреваясь, оно будет излучать волны определенной частоты. Сначала тело покраснеет, а потом и вовсе побелеет. Ученые того времени хотели установить зависимость интенсивности излучаемых волн от температуры тела, но сразу же обнаружили парадокс, который окрестили ультрафиолетовой катастрофой. Британские ученые Рэлей и Джинс вывели формулу, описывающую интенсивность излучаемых волн при различных температурах. Однако, согласно этой формуле, нагретое тело должно излучать волны, приближающиеся к ультрафиолетовой области спектра с интенсивностью, стремящейся к бесконечности, что сильно противоречит практическим наблюдениям.

Немного позже немецкий физик Макс Планк заинтересовался решением проблемы абсолютно черного тела. Планк анализировал результаты экспериментов других ученых в течение долгого времени, и в результате долгих размышлений установил формулу, которая практически идеально описывала наблюдаемые явления по излучению абсолютно черного тела. Сама формула немногим напоминала формулу лорда Рэлея и сэра Джинса, но вносила некоторые коррективы, физический смысл которых не мог объяснить сам Планк.
Уравнение Рэлея-Джинс
\[ d \rho ( \nu , T) = \frac{8 \pi k_B T}{c^3}\nu^2 d\nu \]
Уравнение Планка
\[ d \rho ( \nu , T) = \frac{8 \pi h}{c^3} \frac{\nu^3 d\nu}{e^{h \nu / k_B T} - 1} \]
Не пугайтесь, если формулы кажутся вам страшными. Главное, обратите внимание, что они немного похожи.
Планк понимал, что его формула – это нечто революционное, так как в результате вывода он получил новую величину, h, которую считал новой фундаментальной константой. Сам Планк назвал ее "квантом действия", но сейчас мы с вами именуем ее «постоянной Планка». В чем же на самом деле была революционность формулы Планка?
Во-первых, согласно формуле Планка стало ясно, что энергия – это дискретная величина. Это означает, что энергия не может принимать абсолютно любое значение, а может лишь находиться на определенных "ступеньках". Кстати, говоря "ясно", имеется в виду, что это очевидно нам с вами, а вот каких-то \(100\) лет назад это было объектом жарких споров в научном сообществе, которые не утихали десятилетиями.
Во-вторых, именно введенные Планком новые константы и понятие о дискретности энергии и положили начало развитию новому разделу физики – квантовой механике.
Но почему это все вообще важно химикам? Квантовая механика выходит на сцену в те моменты, когда бессильна классическая. На атомарном уровне законы классической механики не работают, и чтобы разобраться, как устроены электроны, отвечающие за все химические свойства, мы и продолжаем изучать и погружаться глубже в малопонятный нам мир квантовой химии.
Следом за Планком последовали открытия и других ученых, прорубившие окно в мир квантовой механики. Луи де Бройль, например, описал теорию корпускулярно-волнового дуализма, подразумевающую, что электрон (а также фотон и многие другие частицы) не является просто частицей в привычном нам понимании, а также может обладать и волновыми свойствами. Связь между корпускулярными (с др.-греч. корпускула – частица) и волновыми свойствами описывается волной де Бройля:
\[ \lambda = \frac{h}{p} \], где \( \lambda \) – длина волны; \( h \) – постоянная Планка; \( p \) – импульс движущейся частицы.
Корпускулярно-волновой дуализм – это очередное доказательство того, что планетарное представление о строение атома – это лишь упрощение реального положения дел. В атоме электроны не вращаются по четким орбитам вокруг ядра. Согласно квантовой теории их поведение описывается функцией, прозванной волновой (\( \psi \)). Таким образом, электрон – это и волна, и частица в одном лице, а орбиталь – это та область пространства, где описана волновая функция электрона.

В первые годы своего становления квантовая механика порождала много споров и скандалов, но сейчас ее существование не оставляет каких-либо сомнений. За годы её становления появилось много ученых, имена которых находятся на слуху: Шрёдингер, описавший поведение электрона, Гейзенберг, записавший уравнение неопределённости, Фейнман, давший начало квантовой электродинамике, и многие другие. Об этих явлениях вы можете подробнее почитать в статье "Я знаю, что ничего не знаю", написанной в рамках проекта "В чем прелесть физики".
Динамика и химическая кинетика
Чтобы описывать протекание химических процессов, необходимо понимать, как различные элементы химической системы взаимодействуют между собой. Изучением таких взаимодействий занимается химическая динамика.
Химическая динамика – довольно крупный раздел, поэтому сейчас остановимся только на одном из самых важных его подразделов, изучающем скорость реакций. Этот подраздел – химическая кинетика. Именно благодаря кинетике можно разобраться, почему одни реакции протекают быстро, а другие – медленно, и предположить, как ускорить один процесс и избежать образования нежелательных продуктов в другом.
Для начала разберемся, что же такое химическая реакция в своей сущности? Для любой реакции необходимы реагенты – вещества (это могут быть и атомы, и молекулы, и ионы, и радикалы), которые будут претерпевать изменения, превращаясь в продукты. Но для протекания реакции реагентам недостаточно просто превратиться в продукт, перед этим им необходимо преодолеть некий энергетический барьер. Чем более велик этот барьер, тем сложнее реагентам его преодолеть, что и делает химическую реакцию медленнее.

Чаще всего под химической реакцией мы представляем простое столкновение пары частиц, но за одной простой строчкой химического уравнения может скрываться очень сложный процесс, состоящий из нескольких стадий. Как показано на изображении ниже, одна простая реакция образования иодоводорода состоит из трех стадий. Изучением таких механизмов образования веществ также занимается химическая кинетика, что помогает улучшить процессы производства различных химических соединений.

В химической кинетике появляется новая величина, известная как константа скорости химической реакции (строчная k), без которой никакой химической кинетики и не было бы. Известно, что скорость химической реакции зависит от количества реагентов в системе: зачастую чем больше реагентов, тем быстрее протекает реакция. Так вот, константа скорости описывает, насколько быстро протекает реакция вне зависимости от количества реагента.
Теперь, имея общее представление о химической реакции, приходит осознание, насколько сильно ее скорость подвержена влиянию разнообразных факторов: от температуры до пространственного расположения молекул. Все эти факторы находят свое место в математических уравнениях, вроде уравнения Аррениуса, связывающего константу скорости, энергетический барьер, температуру и некоторые физические постоянные. Таким образом, зная энергетический барьер реакции, вполне можно рассчитать, как изменится скорость реакции при увеличении температуры с привычной комнатной до, скажем, \(200\) градусов по Цельсию.
Один из важных подразделов химической кинетики – это катализ. Когда упомянутый энергетический барьер слишком высок, реакция протекает очень медленно. Чтобы преодолеть слишком высокий энергетический барьер для быстрого протекания реакции, часто необходимы экстремальные условия ( высокое давление и температура). Но создание этих самых экстремальных условий – дорогостоящий, энергозатратный и временами опасный процесс, поэтому химики стараются ускорять химические реакции другими способами. В таких случаях на помощь приходят катализаторы. Катализатор – это вещество, которое буквально ускоряет реакцию, но при этом само в результате реакции не расходуется. Катализатором может быть и маленькая молекула, и очень большой белок.
Наверняка, каждый человек хотя бы раз сталкивался с феноменом катализа в своей жизни. Возьмем, к примеру, перекись водорода – знакомый флакон, встречающийся во многих аптечках. Реакция разложения перекиси водорода выглядит следующим образом: \[ 2H_2O_2 \rightarrow 2H_2O + O_2 \] Эта реакция протекает очень медленно, так как её энергетический барьер достаточно велик. Но как только вы начнёте обрабатывать ссадину раствором перекиси, сразу же заметите бурное выделение газа кислорода, что свидетельствует о быстром протекании реакции. Почему это происходит? Попадая на ссадину, перекись взаимодействует с ферментами крови, биологическими катализаторами организма, которые и ускоряют реакцию разложения.
В современной химии синтез новых катализаторов – это объект работы множества лабораторий по всему миру. Новые катализаторы могут помочь нам удешевить некоторые промышленные процессы, сделать синтез лекарств более точным и сымитировать работу биологических катализаторов in vitro.
in vitro означает эксперименты над живыми клетками, которые проводятся вне их биологической среды обитания. Иными словами, эксперименты в пробирке.
Вывод
Физическая химия велика и необъятна, а ее элементы есть в любом химическом исследовании. Анализ сложных органических молекул, контроль производства желаемого продукта в ходе органического синтеза, дизайн сложных биомолекул, разработка инновационных биотехнологий – все это и многое другое есть результат нашего понимания физической химии. Не страшитесь больших математических формул и выражений, ведь физическая химия намного интересней, чем кажется на первый взгляд!
Фонд «Beyond Curriculum» публикует цикл материалов «В чем прелесть предмета» в партнерстве с проектом «Караван знаний» при поддержке компании «Шеврон». Караван знаний – инициатива по исследованию и обсуждению передовых образовательных практик с участием ведущих казахстанских и международных экспертов.
Редактор статьи: Дарина Мухамеджанова
