Болашақ балаңыздың көзінің түсін таңдағыңыз келе ме? Гендік ауруларға "Сау!" дейтін күн туа ма?
Елестетіп көріңізіші: генді өзгерте салып, тұқымқуалайтын ауруды емдеуге, я болмаса болашақ балаңыздың көзінің түсін таңдауға болса, керемет емес пе?
Сонау 1953 жылы Francis Crick пен James Watson ДНҚ молекуласының қос спиралді моделін жасап шығарып, Нобель сыйлығын иеленген (1962) кезде-ақ әлем ғалымдарының осы бір генетикалық ақпарды өңдеу және өзгертуді мақсат етіп жүрген еді.
Бұл мақсаттың жетегінде бір ғана емес, бірталай ғалым мен зерттеушілер тобы жұмыс істеді, істеп келеді. Мәселен, \(2018\) жылы қытай ғалымы Хы Зыңкуей (қыт. 贺建奎) алғаш рет адам геномына өзгеріс енгізіп, АИВ жұқпасына шалдықпайтын егіз қыз "жарата" алды. Алайда ғылым жүрген жерде этика да сақталуы тиіс болғасын ғалым әлем жұртшылығының наразылығына ұшырады. Десе де бұл бағыттағы зерттеу жүмыстары жалғасын таба берді, себебі бұл қанша жерден этикаға қайшы болса да, әлеуеті бар бағыт. Ғылымда да спорт секілді мәреге бірінші жеткен (біздің жағдайда ғылыми зерттеу жұмысын жариялаған) адам сыйлыққа (ал ол бізде Нобель) қол жеткізеді. Осылайша осы жылы мәреге жеткен адам(дар?) белгілі болды.

Өзіңіз елестетіп көріңізіші: бір ғана генді өзгерте салып, тұқымқуалайтын ауруды емдеуге, не обырдың алдын алуға, я болмаса тағамның, тіпті болашақ балаңыздың көзінің түсі қандай болатынын шешуге болса, керемет болмас па еді? Бұрын бұның бәрі орындалуы бірталай арман іспетті еді, одан бөлек оның салдары қандай болары әрі қауіпсіздігі күмән тудырып, жалпыға ортақ әдеп нормаларына қайшы болатын. Десе де гендік инженериядағы CRISPR/Cas\(9\) технологиясы ол арманды шындыққа айналдырды. Осы бір технологияның дамуына үлес қосқан Emmanuelle Charpentier мен Jennifer Doudna \(2020\) жылғы химия саласындағы Нобель сыйлығына ие болды.

CRISPR деген не өзі?
Бактерия мен архейдің иммун жүйесі біз бен сіздікіндей емес, себебі біздегі иммунитетті көптеген жасушалар мен одан да ірі құрылымдар қалыптастырса, бактерияның өзі бір ғана жасушадан тұрады. Десе де бұл олар қорғансыз деген сөз емес. Оларды бактериофаг-вирустар мен басқа да патогендерден қорғайтын геном құрылымдары бар: CRISPR және онымен байланысатын Cas нәруыздары. Олар бөгде генетикалық ақпарды анықтап, жоятын арнайы құрылым.
\(1987\) Жапониядаға Осака Университетінің молекулалық биология ғалымы Йошидзуми Ишино (жап. 石野 良純) мен оның әріптестері ішек таяқшасының бір түріннің ДНҚ молекуласында болатын "біртүрлі" кластерлік қайталанымды байқайды. Әдетте тізбек бірінен кейін бірі жалғаса берсе, бұлардың арасында ерекшеленетін бірегей спейсер-тізбектер болған. Бұл қызықты кейінірек басқа ғалымдар да аңғарып, осы бағытта жұмыс жүргізе бастайды. \(2001\) жылы бұл қайталанымдарға CRISPR (clustered regularly interspaced short palindromic repeats — тұрақты аралықта шоғырланған қысқа палиндром қайталанымдар) деген атау қойылады.
Ақырында \(2005\) жылы үш ғалым бір-бірінен тәуелсіз "CRISPR спейсері — бактериофаг ДНҚ-сы мен плазмиданың туындысы" деген тоқтамға келеді. Ашып айтатын болсақ, бактериофаг-вирустар бактерия жасушасын шабуылдағанда вирус ДНҚ-сынан спейсер түзіліп, CRISPR тізбегіне интеграцияланады. Осылайша бактерия жасушасына кезіккен әрбір вирус оның геномына "жинақталып", бактерияның жүре пайда болған иммунитетін қалыптастырады.
Бар болсаң қайдасың?!
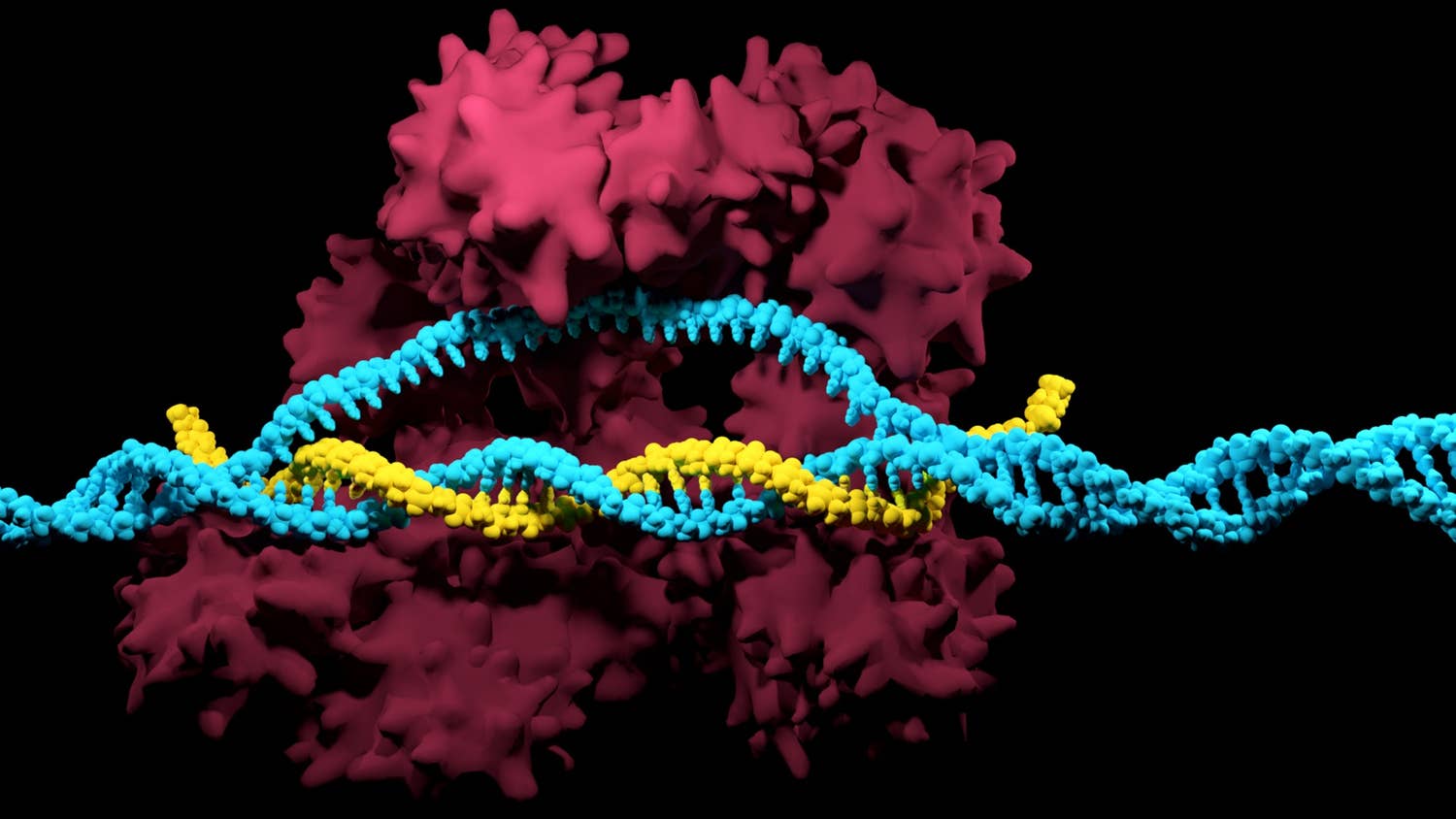
Бөгде ДНҚ қалай анықталады және ондағы ақпар қалайша тізбекке қосылады? Бұл қызметті CRISPR-байланысушы Cas9 деп аталатын арнайы фермент атқарады. Ол бөгде ДНҚ-ны тарқатып, бағыттаушы РНҚ спейсерлеріне сәйкестігін тексереді. Әлгі сырттан енген ДНҚ сәйкес келсе, Cas9 оны қайшы секілді "кесіп", ыдыратып жібереді. Ғалымдардың назарына іліккені де нәруыздың дәл осы механизмі.
Қайшы қалайша кеседі?
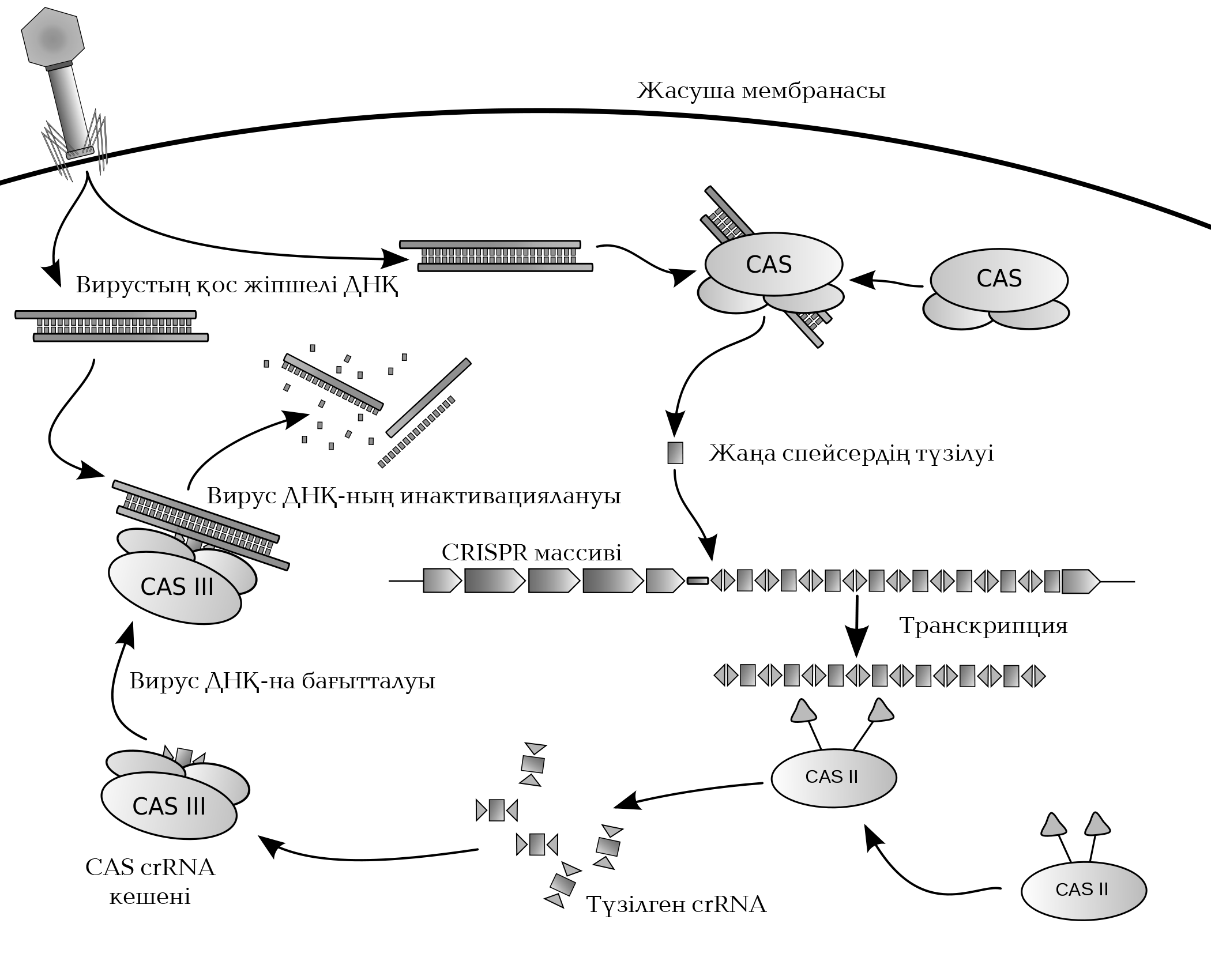
Жоғарыда айтылғанның барлығы құр болжам емес, арнайы зерттеу жұмысы жасалып, соның нәтижесіне сүйеніп айтылған. Бұл нәруыздың барлық қасиеті анықталғаннан кейін ғалымдар өз гипотезасын дәлелдеу үшін Streptococcus thermophilus колониясына аса қауіпті бактериофаг жұқтырып, "аман қалғандарын" бөліп алады. Фагтың шабуылынан адаптация арқасында аман қалған бактериялар өз CRISPR-ін спейсер есебінен толықтырып алады, ал олар тура фаг ДНҚ-сының тізбегін қайталайды. Демек, CRISPR массивіндегі спейсер тізбектері — кезінде кездескен вирустың не басқа да агенттің генетикалық ақпары екеніне толықтай көз жеткізеді.
CRISPR локусына ұзындығы \(550\) ж.н. болатын жетекші тізбек пен Cas тобына жататын нәруыздарды кодтайтын CRISPR-байланысушы гендері (CAS) байланысады. Жетекші тізбек CRISPR массивінің транскрипциясы үшін промотор рөлін атқарады.
Осыдан кейін CRISPR транскрипциясынан пайда болатын ұзын РНҚ молекуласы бірнеше фрагментке бөлшектенеді. Олар CRISPR РНҚ (crRNA) деп аталады (олардың әрқайсында спейсер мен қайталаным бөлігі болады). Фрагменттерге бөлшектеуге қайталанымға комплиментар tracrРНҚ молекуласы қатысады, ол Cas\(9\) нәруызына «жеңгетай» рөлін атқарады, ал оған өз кезегінде РНҚ молекуласын қиятын РНҚаза III ферменті байланысады. Өз қызметін атқарып болған РНҚаза III кетіп қалады. Екі crРНҚ мен tracrРНҚ молекуласы Cas9 нәруызымен кешен түзеді. Бұл нәруыз — нуклеаза, яғни ДНҚ молекуласын қияды. Cas9 нәруызы жалғыз өзі белсенсіз, тек tracrРНҚ-пен байланысып, үшөлшемді құрылымы өзгеріп, нысана ДНҚ-мен әрекеттесе алады.
Кейін crРНК/tracrРНК-Cas\(9\) кешені жауына қарсы жорыққа шығады: crРНҚ-ның спейсер бөлігі өзіне комплиментар тізбекті іздеп тауып, оған Cas нәруыздарын алып келеді, олар өз кезегінде жау тізбегін ыдыратып жібереді. Осылайша crРНҚ нуклеазаны нысанаға дейін жетектеп апаратын құрылым, сол себепті оны «РНҚ-гид», «бағыттаушы РНҚ» деп атайды.
Қайшының әлеуеті қандай?
Бұл технологияның болашағынан зор үміт бар, себебі CRISPR/Cas\(9\) ферментін қолданып, генді инактивациялау үшін ДНҚ спиралінде нүктелі кетік, сондай-ақ нүктелі мутация да жасауға болады. Бұдан бөлек геномды үзбестен ген енгізуге, түсіп қалғанын қалпына келтіруге не өңдеуге болады. Бұл әдістің тағы бір артықшылығы – нақтылығында, бақыланбалығында және салыстырмалы түрде оңай болуында. Аталмыш «генетикалық қайшы» генетикалық ауруды емдеуде де қолданылары сөзсіз, мәселен әзірдің өзінде олар гемофилия, Дюшеннің бұлшықет дистрофиясы, жүректің тұқымқуалайтын аурулары мен обырды емдеудегі тиімділігі жайында ақпарат бар. Бұл аз десе, CRISPR/Cas\(9\) адамдағы ауруды моделдеуде, регенерация медицинасында, антимикробтық терапия мен басқа да медицина салаларында қолданылып келеді.
Осылайша кезінде генді редакциялау тек ғалымдардың ойында жүрген гипотеза болса, қазіргі таңда ол мүмкін дүниеге айналуға аз қалды. Бұл "қайшы" көптеген адамның үміт отын тұтата алғаны сөзсіз. Алайда ғылым бар жерде "күдік" болатындықтан, бұл өнертабыс әлі адам баласына қолданылмас бұрын бірсыпыра зерттеуден өтуі керек, себебі бір организмге оң әсерін көрсеткен құрылым, екіншісінде қалай қызмет етерін кесіп ешкім айта алмайды, сол себепті әлемнің бар ғалымдары осы бағытта үлкен ізденіс жүргізуде. Қазірдің өзінде бұл "қайшы" ауылшаруашылығында кең қолданыста екенін атап өту керек: ғалымдар дәл осы қайшыны қолданып геномға өзгеріс енгізгеннің арқасында бұлшықет массасы көп шошқа мен өгіз, ауруға шалдықпайтын әрі көгермейтін өсімдік пен сүті гипоаллергенді сиыр алған.
