Химия цвета
Вы когда-нибудь задавались вопросом: откуда берется цвет? В этой статье мы расскажем, как с химической точки зрения можно объяснить разные цвета соединений.

Почему некоторые химические соединения цветные, а другие нет?
Вообще, химические вещества бывают органические и неорганические. Все вещества, содержащие углерод — это органические вещества (иногда органическую химию называют просто химией углерода). Цветные неорганические вещества обуславливаются одним фактором, а цветные органические — совсем другим, хотя в основе лежит один и тот же процесс.
Начнем с неорганических соединений.
Если посмотреть на периодическую таблицу элементов Дмитрия Ивановича Менделеева в длиннопериодном варианте (изображение ниже), то можно заметить особую группу элементов (химики называют их переходными металлами), которая находится в центре таблицы. Всего 66 переходных металлов, причем 38 из них \(d\)-элементы, а 28 – \(f\)-элементы. В неорганической химии чаще всего окрашены именно соединения переходных металлов.
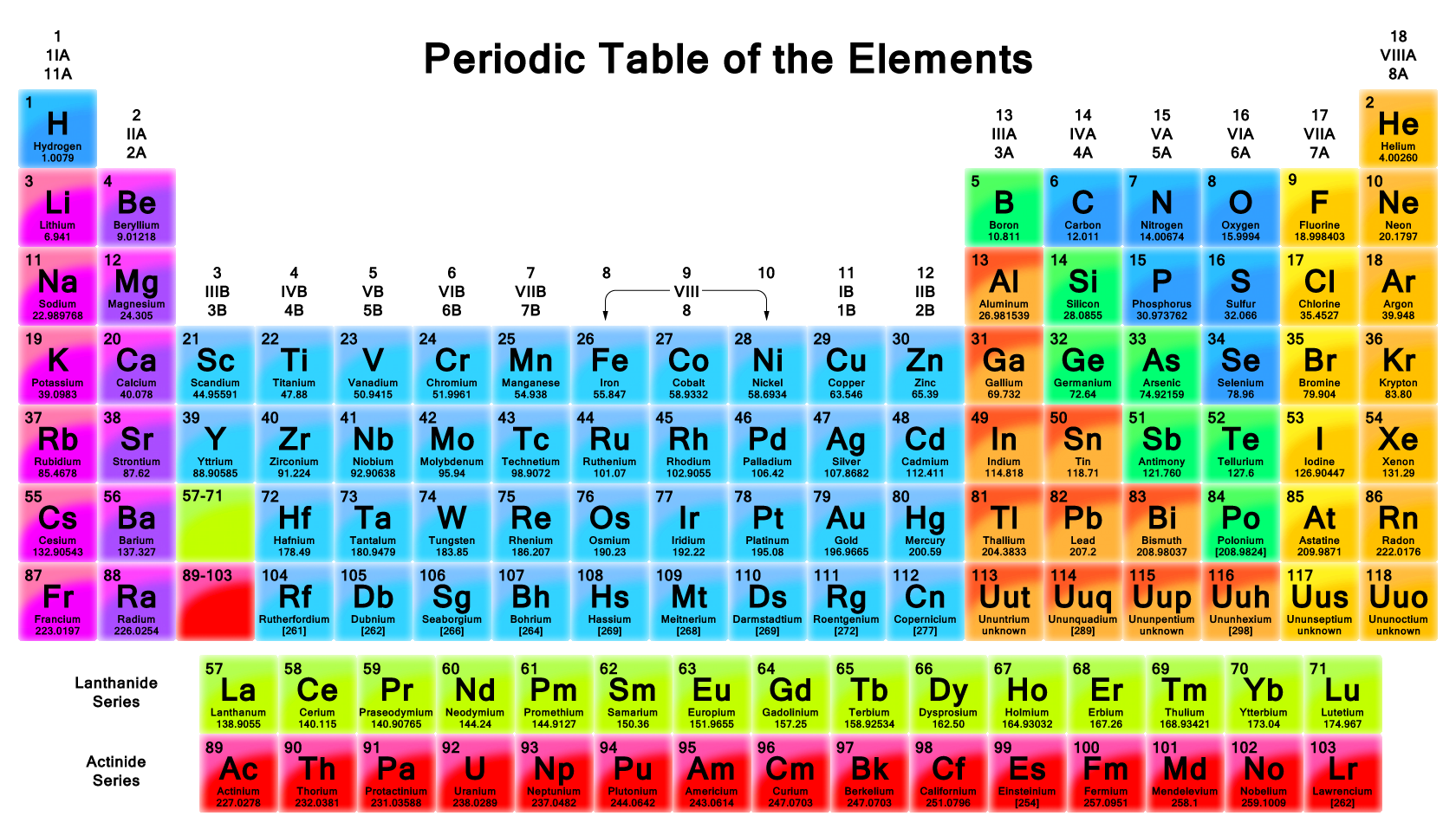
Немного отвлечемся, чтобы понять как устроен атом и где находятся электроны.
Устройство атома
Молекулы состоят из атомов, атомы состоят из ядра и окружающих его электронов. Электроны заряжены отрицательно, поэтому для соблюдения электронейтральности атома, их количество равно количеству положительно заряженных протонов, находящихся в ядре. Ядро состоит из положительно заряженных протонов и нейтронов (не имеющих заряда), но именно электроны представляют нам больший интерес.
Очень знаменитый физик Нильс Бор предложил теорию атома водорода, согласно ее математическому аппарату, скорость электрона в атоме водорода равна 2190 км/с. В атоме водорода всего один протон и соответственно один электрон. По мере увеличения числа электронов они находятся все дальше и дальше от ядра, и их скорость увеличивается. То есть 2190 км/с — это самая минимальная скорость электрона.
Существует некая иерархия электронов в атоме. Сначала есть энергетические уровни — 1, 2, 3, 4, 5, 6, 7, потенциально могут быть и дальнейшие, но пока изучено 118 элементов, и электроны последнего умещаются на 7 уровнях. Энергия этих уровней возрастает от 1 и выше. Затем есть электронные орбитали — \(s\), \(p\), \(d\), \(f\), которые различаются по своей форме. Энергия орбитали тоже возрастает начиная от \(s\) и выше в том порядке, в котором они перечислены. Что такое орбиталь? В общем, любая точка внутри орбитали — это положение, в котором электрон может находиться с наибольшей вероятностью. Трудно уследить за маленькой частичкой, масса которой \(9\cdot 10^{–31}\) кг и которая двигается с огромными скоростями, поэтому согласно квантовой теории говорят о том, где вероятность нахождения электрона наивысшая.
На каждой из орбиталей может находиться некое количество электронов на s — 2, на p — 6, на d — 10, на f — 14. Поэтому электроны можно называть \(1s\), или \(2s\), или \(2p\), или \(3s\), или \(5s\) и так далее. В принципе, можем возвращаться к переходным металлам. Любые химические соединения образуются благодаря спариванию электронов двух элементов (электронов наиболее удаленных от ядра).
Цвета соединений переходных элементов
Переходные металлы обладают уникальным свойством, у них наиболее удаленные орбитали — \(d\) или \(f\). Помните мы употребляли термины \(d\)-элемент и \(f\)-элемент? Это просто показатель где находятся валентные электроны (т.е участвующие в образовании химической связи). А чем же особенны \(d\) и \(f\) орбитали? В них помещается очень много электронов, 10 и 14 соответственно. Более того, согласно Теории Кристаллического поля, внутри \(d\)-орбитали есть различные положения, обладающие разной энергией, которые может занимать электрон, .
Если сообщить электрону энергию (облучить электромагнитной волной) — он займет положение с высшей энергией. Если у электрона будет возможность занять положение с низшей энергией — он займет ее, а избыток энергии излучится в виде электромагнитной волны. От разницы энергий двух состояний зависит какая электромагнитная волна излучается или поглощается.
Внутри \(d\)- и \(f\)-элементов электроны могут поглощать электромагнитные волны из видимого диапазона, этот процесс называется возбуждением электрона (когда он занимает высшую по энергии позицию). Почему именно из видимого диапазона? Так получается, что именно волны этого диапазона обладают достаточно высокой энергией для возбуждения, при этом достаточно низкой энергией, чтобы предотвратить переходы электрона на другую орбиталь, или вовсе другой энергетический уровень.
Любое соединение \(d\)- и \(f\)-элемента поглощает определенную волну из видимого диапазона, причем длина поглощаемой волны зависит от природы элемента. И то, что происходит дальше — крайне интересно. Любой белый свет состоит из всех волн видимого диапазона (все же знают опыт по разложению спектра на его составляющие?). Когда белый свет проходит сквозь эти соединения, поглощается определенная длина волны. И что мы видим? Мы видим весь спектр без одной какой-то волны, к примеру синей, поэтому соединение уже не может быть бесцветным, нам оно кажется окрашенным.
Еще интересней тот факт, что в соединениях эти \(d\)- и \(f\)- элементы отдают электроны другим элементам, и в зависимости от того, сколько электронов отдаст элемент — будет различаться цвет соединения. Например, если марганец отдаст 7 электронов, то соединение будет фиолетовым (марганцовка), если он отдаст 6 электронов — соединение будет темно зеленым, а если отдаст 4 — темно-коричневым, почти черным.

Перейдем к органическим соединениям.
Здесь похожий принцип, только в иной форме.
Нам нужно изучить сопряженные органические вещества. Как я уже говорил, все органические соединения содержат углерод, причем только в молекуле природного газа (метан) всего один атом углерода, а в остальных молекулах присутствуют связи углерод-углерод. Более того, связи могут быть одинарными, двойными и тройными.
Сопряженные соединения — это такие соединения, в которых идет чередование двойных и одинарных связей по типу углерод-углерод. Например, \(CH_2=CH-CH=CH-CH=CH_2\) (где C — атом углерода, H — атом водорода). Все связи между атомами образуются перекрыванием электронных облаков, то есть электроны двух атомов становятся общими. Любая одинарная связь образована двумя электронами. Двойная связь — это сочетание одинарной связи и еще одной очень интересной связи, которая называется пи-связь. Электроны, образующие пи-связь обладают гораздо большей свободой, чем электроны, образующие обычную связь. Поэтому, в сопряженных соединениях они могут грубо говоря гулять по молекуле (только внутри сопряженной части молекулы), то есть они делокализуются. Этот момент пригодится чуть позже.
Когда образуется пи-связь, электроны занимают новые молекулярные орбитали (их количество равно числу электронов образующих связь). Сопряженные системы поглощают электромагнитные волны из ультрафиолетового спектра для того чтобы пи-электроны могли переместиться с высшей, по энергии, занятой молекулярной орбитали (ВЗМО) на низшую, по энергии, не занятую молекулярную орбиталь (НСМО).
Но мы знаем, что ультрафиолетовая область граничит с областью видимого света. Поэтому в соединениях с очень большими сопряженными системами (много чередующихся двойных и одинарных связей), электроны распространены на настолько большое расстояние (о чем я говорил ранее), что они обладают совсем маленькой энергией (чем больше пространства для движения электрона — тем меньше его энергия), и соответственно им нужно поглотить меньшую энергию для перескока электрона на другую молекулярную пи-орбиталь. Усиливает этот эффект тот факт, что в больших системах много молекулярных орбиталей, то есть у электрона много вариантов куда перескочить, и наверняка найдется возможность перескочить с минимальной разницей в энергии.
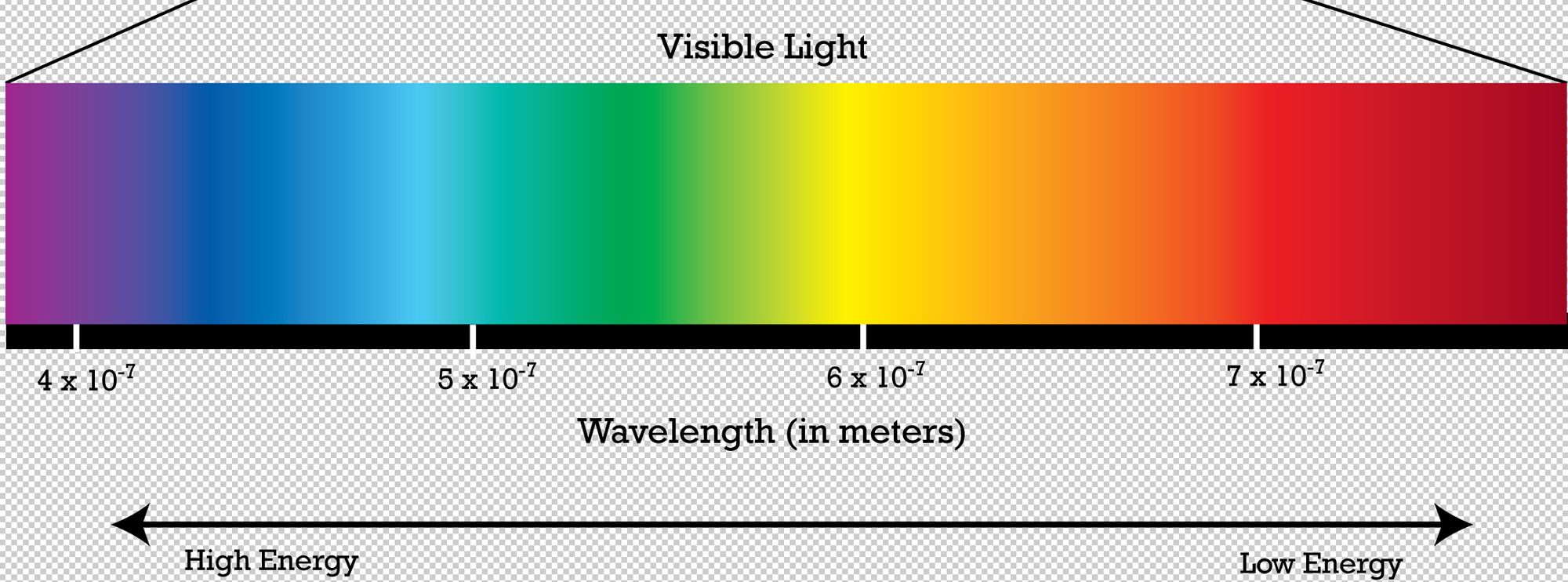
Если, посмотреть на электромагнитный спектр, мы заметим, что у ультрафиолетовых волн длина волны меньше, чем у видимого света. То есть, их частота больше и энергия выше, чем у видимого света. И получается, что в больших сопряженных системах нет смысла поглощать ультрафиолетовые лучи, ведь есть возможность поглощать видимый свет (таковой возможности нет у маленьких сопряженных систем).
Отсюда можно заключить следующую тенденцию — чем больше сопряженная система, тем ниже нужна энергия для осуществления электронных переходов, и тем дальше идет сдвиг в сторону микроволн. Разные сопряженные системы поглощают электромагнитное излучение разных длин волн. Например, тот самый пигмент из морковок, бета-каротин, содержит 11 двойных связей в сопряжении и поглощает свет с длиной волны 455 нм.
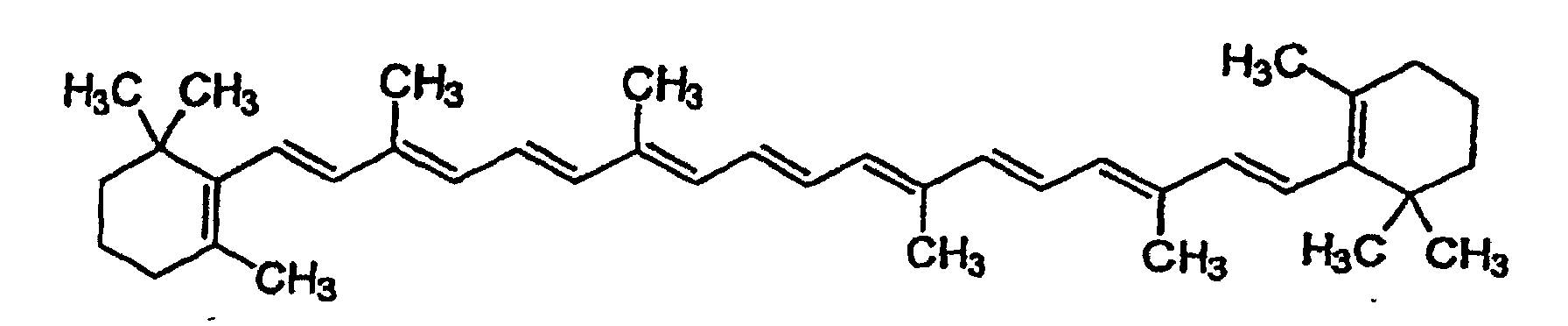
Белый свет от солнца или настольной лампы, как я уже говорил ранее, состоит из волн всех длин видимого региона. Когда белый свет проходит через бета-каротин, волны с длиной от 400 до 500 нм (соответствующие синему цвету) поглощаются, а все остальные проходят дальше и достигают наших глаз. Таким образом, мы видим свет, без одной волны синего цвета, и получаем желто-оранжевую окраску для бета-каротина.
Что особенно интересно, так это то, что сопряженные соединения могут видоизменяться в зависимости от кислотности среды, то есть меняется и цвет самих соединений. Вот почему, например, цвет плодов меняется с зеленого на красный по мере созревания.
Эта статья является переизданием одноименной статьи из журнала Квазар от 15 января 2016 года. Многие авторы статей Квазара теперь являются участниками команды BeyondCurriculum и пришли к выводу, что некоторым людям может быть удобнее получать информацию в виде коротких статей онлайн. Если вы хотите получить полноценный опыт от чтения журнала, мы приглашаем вас скачать pdf с сайта Квазара.
Автор оригинальной статьи: Антон Моргунов
Редактор переиздания: Владислав Черданцев
