[Прелесть химии] Строительные блоки материи: от элементарных частиц до супрамолекул
![[Прелесть химии] Строительные блоки материи: от элементарных частиц до супрамолекул](/content/images/size/w2000/2020/10/wallpapersden.jpg)
Все статьи из цикла "В чем прелесть предмета"
Другие статьи из цикла "В чем прелесть химии":
Зачем учить физхимию?
Неорганическая химия
Органическая химия
Полимеры
Синтез жизни
Чистый воздух
Химия и медицина: химическое оружие, аспирин и плесень
Атомный мир
Задавались ли вы когда-нибудь вопросом, почему некоторые люди тратят целую жизнь на изучение какой-нибудь науки, скажем химии, или сутками сидят в лабораториях, постигая глубины этого мира и расширяя границы нашего познания? Если вас интересовали ответы на эти вопросы, а может быть вам и самим интересна наука, то данная публикация, которой мы открываем цикл статей “В чем прелесть химии”, поможет разобраться в особенностях такой потрясающей науки, как химия. Но для начала нужно понять, что же вообще изучает химия?
Еще в XVII веке английский ученый Роберт Бойль, основоположник современной химии и научного метода, обозначил задачей химии изучение элементов, их соединений и свойств. Как вам наверняка известно из уроков естествознания, абсолютно все окружающие нас тела, будь то летающая в комнате пылинка или газовый гигант Юпитер, состоят из молекул, а те, в свою очередь, – из атомов. Таким образом, основной задачей химии является изучение нашего сложного мира на атомно-молекулярном уровне. Для этого, конечно, необходимо точно знать строение самих строительных блоков материи. Давайте же разберемся, как устроены атомы и молекулы, перед этим немного окунувшись в историю атомно-молекулярной теории.
История атомно-молекулярной теории
Как бы естественно и очевидно для нас не звучало утверждение, что вся материя состоит из атомов, вплоть до XVIII века этот факт был причиной споров лучших умов своего времени. Первые предположения о том, что все вещества состоят из мельчайших неделимых частиц, были выдвинуты древнегреческими философами. Даже само слово атом происходит от древнегреческого ἄτομος, что означает «неделимый». Однако уже в Средние века атомизм почти полностью отошел на задний план и был заменен другими теориями, такими как учение о четырех элементах-стихиях и алхимией.
Лишь в конце XVII века с распространением научного метода атомизм стал вновь набирать популярность среди ученых. Именно с этого времени, когда уже опытным путем было открыто и доказано существование некоторых отдельных химических элементов, понятия «атом» и «молекула» прочно укрепились в научных кругах. Но изучение атомов на этом вовсе не прекратилось, а только начало набирать обороты. В \(1897\) году английский физик Джозеф Джон Томпсон, исследуя катодные лучи, получаемые при пропускании высокого напряжения в разряженном газе, открыл первую субатомную частицу – электрон. Так, долгое время считавшийся неделимым, атом сам оказался состоящим из более мелких частиц. Чуть позже Эрнест Резерфорд, отец ядерной физики, доказал, что атом состоит из двух основных частей: положительно заряженного ядра и электронов, вращающихся вокруг него. Тогда он предложил свою знаменитую планетарную модель атома, по сей день являющуюся одним из главных символов науки.
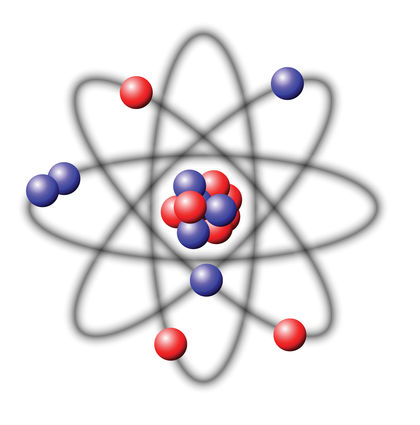
Атомное ядро
Давайте подробнее остановимся на строении атомного ядра. Оно находится в центре атома и состоит из положительно заряженных протонов и нейтронов, не несущих какого-либо заряда. Сами протоны и нейтроны не являются элементарными частицами, так как состоят из более мелких частиц – кварков (это уже является вопросом изучения не химии, а скорее физики элементарных частиц). Несмотря на то, что размер ядра примерно в 10000 раз меньше размера самого атома, за счет большой разницы в массе между электронами и нуклонами (так совокупно называют протоны и нейтроны), почти вся масса атома, около \(99.97\) %, сосредоточена именно в ядре.
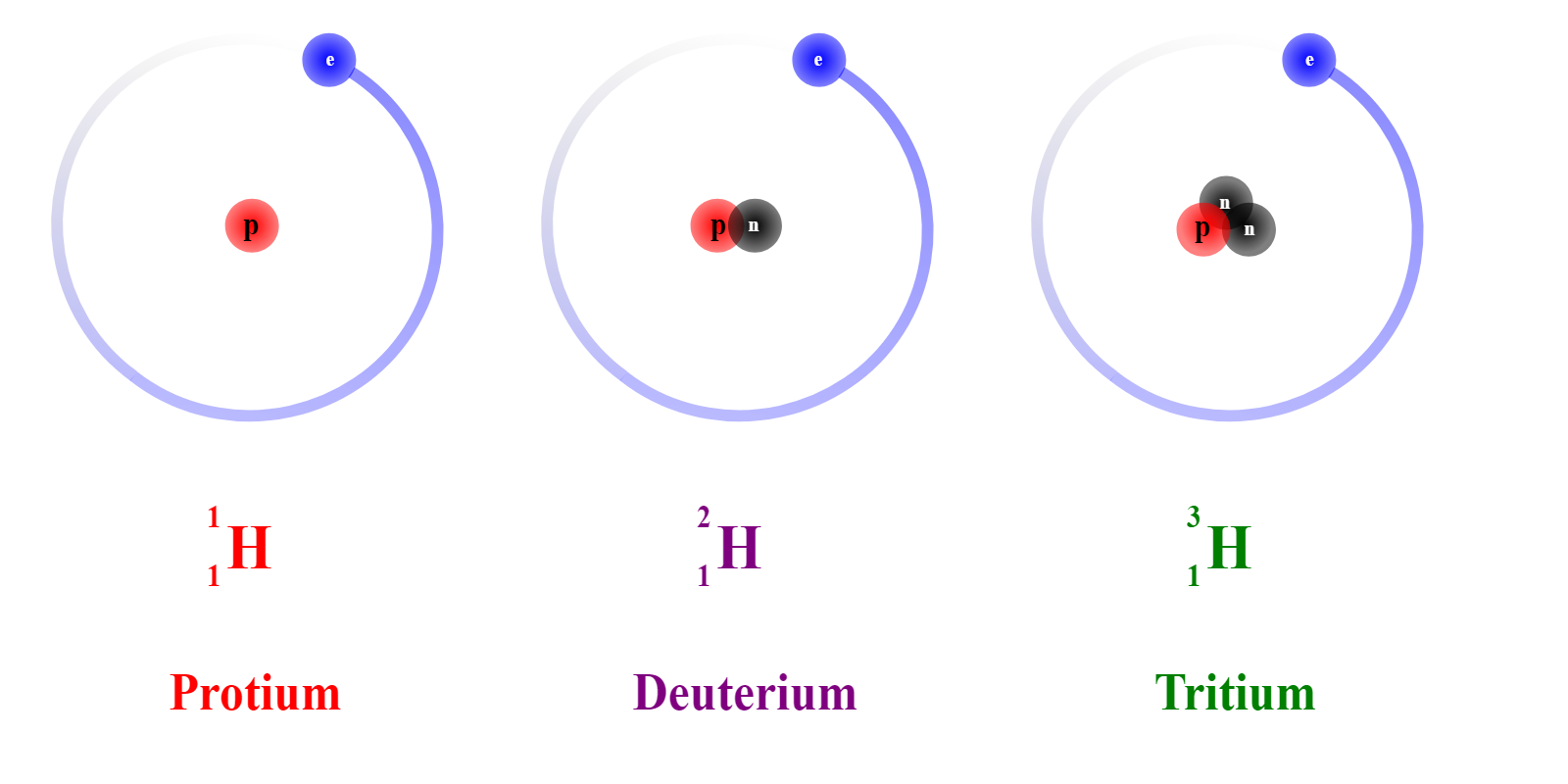
Для каждого химического элемента количество протонов в ядре постоянно, а вот количество нейтронов может быть разным. Атомы одного химического элемента, имеющие разное количество нейтронов в ядре, называют изотопами. Например, у водорода существует три изотопа, встречающихся в природе: протий (\(1\) протон, \(0\) нейтронов), дейтерий (\(1\) протон, \(1\) нейтрон) и тритий (\(1\) протон, \(2\) нейтрона). Основную часть всех атомов водорода в природе составляют атомы протия, остальные изотопы содержатся в очень небольших количествах, но даже так ученые находят им применение. Дейтерий, например, часто применяют в ядерной энергетике и используют для изучения механизмов химических реакций, а в последнее время дейтериевозамещенные соединения стали использовать и в медицине.
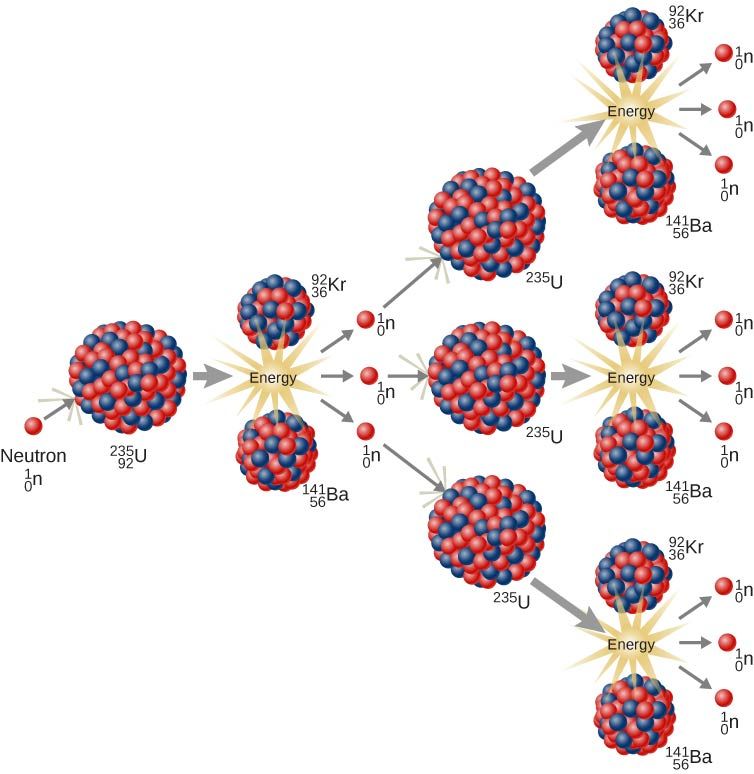
Радиоактивность
У одного элемента может быть несколько изотопов, при этом некоторые из них имеют нестабильные ядра, способные самопроизвольно распадаться. Это явление называется радиоактивностью.
Радиоактивность бывает природной (вы наверняка слышали о радиоактивном уране) и искусственной, так как радиоактивный распад можно вызвать путем искусственных ядерных реакций. Искусственный радиоактивный распад, например, применяется в ядерных реакторах: ядра урана бомбардируют нейтронами, при этом запускается серия последовательных распадов и выделяется большое количество энергии.
Однако радиоактивность находит применение и в других областях, помимо энергетики, к примеру медицине при позитронной эмиссионной томографии (диагностическом методе, позволяющем определить расположение раковых опухолей и метастазов в организме человека). В данном методе пациенту вводят инъекцию фтордезоксиглюкозы, содержащей радиоактивный изотоп фтор-\(18\), после чего молекулы этой “радиоактивной” глюкозы накапливаются в злокачественных клетках.
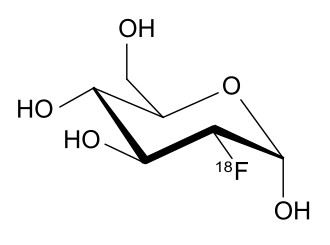
Атомы радиоактивного изотопа фтора в течение короткого времени подвергаются радиоактивному распаду, испуская при этом позитроны (античастицы электрона), которые детектируются специальным оборудованием. Таким образом удается с высокой точностью определить локализацию злокачественной опухоли для дальнейшего лечения. Сама же фтордезоксиглюкоза синтезируется прямо перед самой процедурой, причем осуществлять синтез необходимо быстро, чтобы атомы фтора не успели распасться в большом количестве. Кстати, разработкой синтезов подобных соединений занимается органическая химия, о которой вы можете прочитать в следующих статьях нашего цикла. Так на стыке трех наук – химии, физики и биологии – была разработана методика, помогающая тысячам пациентов, нуждающихся в качественном лечении, оказаться ближе к победе над таким опасным заболеванием, как рак.
Самые важные частицы нашего мира
В ходе химических реакций атомное ядро не подвергается никаким изменениям, а соответственно его строение с трудом может объяснить те или иные свойства элемента. Куда более большую значимость для химиков представляет электронное окружение атома, которое как раз и объясняет большинство химических и физических свойств всех существующих элементов. Долгое время считалось, что электроны, подобно планетам вокруг Солнца, вращаются вокруг ядра по определенным траекториям. Это та самая планетарная модель, о которой мы говорили выше. Но данная модель не полностью соответствовала реальности, а значит требовала усовершенствования. Со временем ученые поняли, что объяснить поведение электронов с помощью привычных нам законов макромира, то есть законов классической механики, просто невозможно, ведь на субатомном уровне все работает совершенно по-другому. Оказалось, что электрон вовсе не является частицей в привычном для нас понимании: он настолько быстро движется вокруг ядра, будто одновременно присутствуя в нескольких точках пространства, что обретает признаки волны. Впоследствии в ходе исследования атома и его составляющих появилась квантовая механика, раздел науки, в котором учитывается такая двойственная природа электрона. Из-за некоторых непривычных для нашего понимания законов квантовая механика обрела репутацию сложной и запутанной науки. На самом же деле, она невероятно удивительна и логична и, что немаловажно, изучает поведение электронов – самых важных частиц нашего мира.

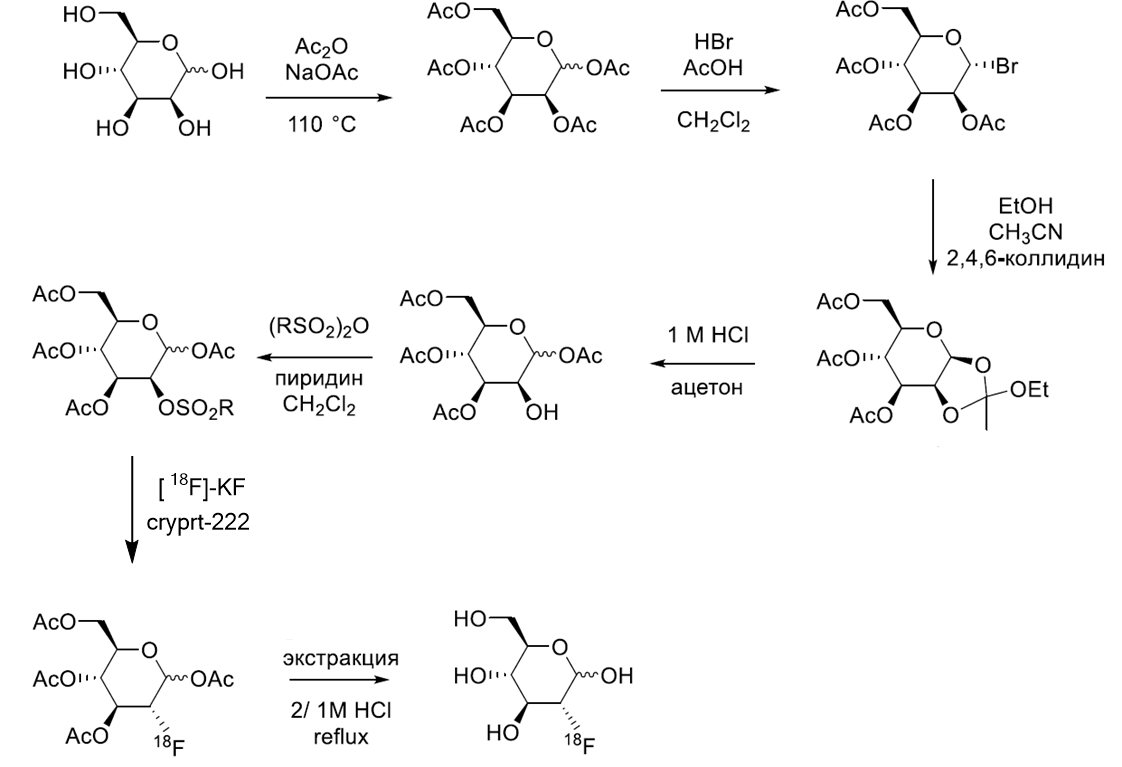
Давайте перейдем к расположению самих электронов. Количество электронов в атоме равно количеству протонов, так как атом электронейтрален. Любой электрон движется вокруг ядра не в хаотичном порядке, а в определенной области пространства, которая называется атомной орбиталью. Каждая атомная орбиталь имеет свою определенную форму и энергию и может вместить два электрона.
По мере увеличения заряда ядра, а соответственно и увеличения числа электронов в атоме, между электронами на атомных орбиталях возникают все более сложные взаимодействия, увеличивающие общую энергию атома. Но, как известно, все в нашем мире, включая атомы, стремится к минимуму энергии. Оказалось, что наименьшая энергия атома достигается в том случае, если у него заполнен внешний электронный уровень (в большинстве случаев это крайние 8 электронов), и тогда разница между энергиями притяжения электронов к ядру и взаимного отталкивания между самими электронами на одной орбитали становится наименьшей. Но как же атом может сделать так, чтобы у него было 8 заветных электронов на внешнем уровне? Ответ прост – взаимодействуя с другими атомами. Атомы, словно люди, связанные общими интересами, делятся своими электронами друг с другом, тем самым образуя химические связи.
Межмолекулярные взаимодействия
Получается, что атомы и состоящие из них молекулы, способны реагировать друг с другом, образуя новые химические соединения со своими уникальными свойствами. По своей природе все соединения делятся на две большие группы: органические и неорганические, а изучением этих двух групп веществ занимаются соответственно органическая и неорганическая химия. Об этих разделах вы можете подробнее прочитать в следующих статьях нашего цикла.
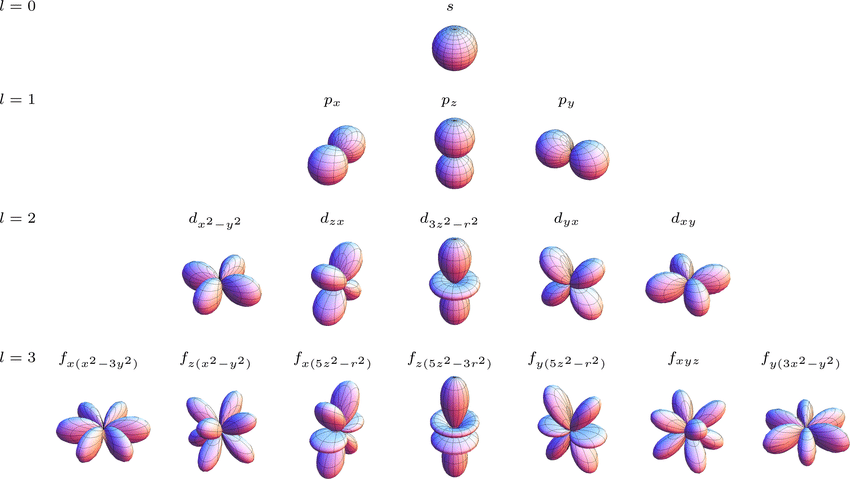
Однако, существуют и взаимодействия между молекулами, не приводящие ни к каким химическим реакциям. Давайте рассмотрим две очень похожие друг на друга молекулы – воды \(H_2O\) и сероводорода \(H_2S\). Как вы знаете, при комнатных условиях вода находится в жидком состоянии, а вот сероводород – в газообразном. Казалось бы, более тяжелые молекулы сероводорода должны образовывать более плотное вещество, но в действительности все происходит наоборот. Почему? Ответ кроется в межмолекулярных взаимодействиях.
Начнем с того, что атомы кислорода и серы являются более электроотрицательными, чем атомы водорода, а соответственно они оттягивают часть электронной плотности на себя (проще говоря, перетягивают электроны другого атома к себе). Таким образом на атомах серы и кислорода создается частично отрицательный, а на атомах водорода – частично положительный заряд, которые притягиваются друг к другу. Но у атомов кислорода есть одно существенное отличие от атомов серы – они меньше по размеру. Это делает их сопоставимыми по размерам с атомами водорода, а значит и межмолекулярная связь между ними более прочная.
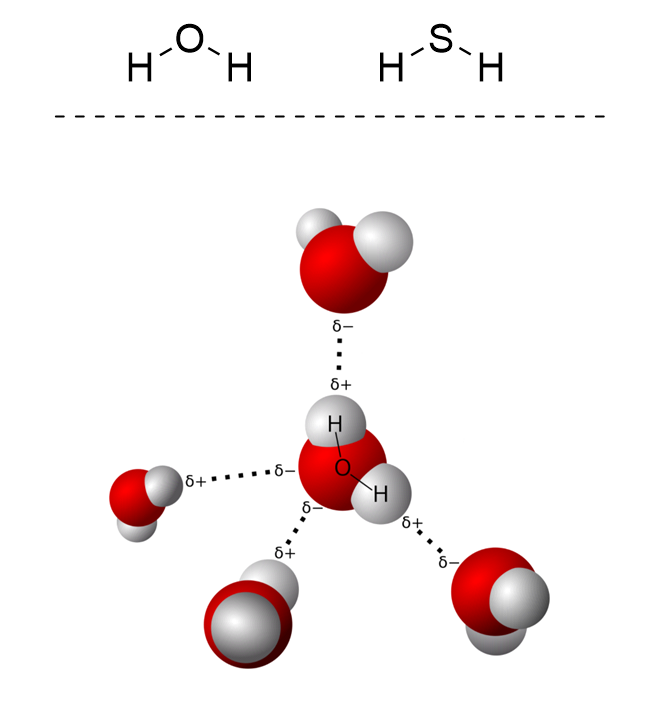
Эти дополнительные взаимодействия прочно удерживают молекулы воды вместе, не давая им разлететься и стать газом. А вот молекулы сероводорода сдерживаются гораздо хуже, поэтому и образуют газообразное вещество.
Разнообразие химических соединений
Объединение атомов в молекулы — это далеко не предел. Молекулы и сами способны объединяться в более сложные структуры, такие как полимеры, из которых, к слову, состоит практически весь окружающий нас мир. Подробнее о полимерах вы сможете прочитать другой статье этого цикла.
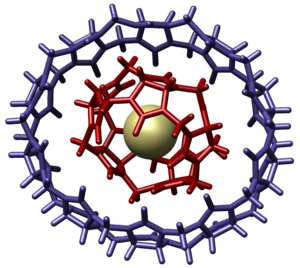
Более того, крупные молекулы также могут взаимодействовать друг с другом с образованием сложных, комплексных структур – супрамолекул. Мы уже писали о катенанах и ротаксанах, являющихся примерами супрамолекул. Они могут быть использованы в качестве хранителей информации или молекулярных моторов. Тем не менее в последнее время исследователи все чаще рассматривают супрамолекулы в качестве доставщиков медицинских препаратов. Так, молекулы кукурбит[7]урила (на изображении ниже) способны вместить в себя молекулы оксалиплатина – важного лекарственного препарата, используемого для лечения рака. В комплексе с супрамолекулой, молекулы лекарства лучше доставляются к необходимым клеткам, тем самым увеличивая шансы на успешное лечение.
Заключение
Что же все-таки привлекает людей в химии? А вот именно это невероятное разнообразие удивительных химических соединений, их свойств и способов их применения в реальной жизни будоражит умы тысяч и миллионов людей по всему миру.
С помощью строительных блоков всей материи мы уже научились создавать удивительные молекулы: одни помогают находить раковые опухоли, другие – эффективно доставлять медицинские препараты, третьи используют для покрытия космических шаттлов. И это далеко не все! За долгие годы развития науки мы исследовали лишь малую часть того, что нам еще предстоит узнать. Химия таинственна и безгранична, и каждый день ученые всего мира просыпаются с целью чуть глубже познать наш поразительный мир. Что это, если не прелесть химии?
Фонд «Beyond Curriculum» публикует цикл материалов «В чем прелесть предмета» в партнерстве с проектом «Караван знаний» при поддержке компании «Шеврон». Караван знаний – инициатива по исследованию и обсуждению передовых образовательных практик с участием ведущих казахстанских и международных экспертов.
Редактор статьи: Дарина Мухамеджанова.
